[SKinno Tech] 기계의 효율성과 수명을 높이는 윤활유
2025.01.20
 트렌드 & 리포트
트렌드 & 리포트
2019년 10월, 97세 나이의 역대 최고령 노벨상 수상자가 탄생했다. 2023년 타계한 미국 텍사스대 오스틴캠퍼스 존 굿이너프(John B. Goodenough) 교수다. 그와 함께 뉴욕주립대 빙햄튼캠퍼스 스탠리 휘팅엄(M. Stanley Whittingham) 교수, 일본 메이조대학 소속 기업 아사히카세이(Asahi Kasei)의 명예 펠로 아키라 요시노(Akira Yoshino) 등 세 명의 과학자가 스웨덴 왕립과학원 노벨위원회로부터 노벨화학상을 공동 수상했다.
충전이 가능한 2차전지는 1850년대 등장했지만 본격 상용화된 시점은 리튬이온 배터리가 연구 및 개발된 이후다. 노벨위원회가 2019년, 세 명의 과학자를 수상자로 선정한 이유도 ‘리튬이온 배터리’ 발전에 기여한 공로 덕이다. 노벨위원회는 “충전식 리튬이온 배터리는 휴대폰, 노트북과 같은 무선 전자기기의 토대를 마련했다. 또한, 전기차에 동력을 공급하는 것부터 재생에너지 저장까지 인류를 화석연료로부터 해방하는 기틀을 마련했다”고 이들의 선정 사유를 밝혔다.
| 2차전지의 4대 핵심 요소
2차전지는 방전과 충전이라는 두 가지 과정을 통해 놀라운 능력을 발휘한다. 방전 시 음극(-)에서는 산화 반응이 일어나고, 양극(+)에서는 환원 반응이 일어난다. 이때 전자가 음극에서 양극으로 이동한다. 반대로 충전 과정은 외부 전원에 의해 전자가 양극에서 음극으로 이동하게 돼 화학반응이 역방향으로 진행된다. 리튬이온 배터리의 경우 리튬이온이 음극으로 이동하면 배터리가 충전되고, 반대로 음극의 리튬이온이 양극으로 돌아가면 방전된다.
이러한 2차전지를 구성하는 4대 핵심 요소는 양극, 음극, 분리막, 전해질을 꼽을 수 있다.
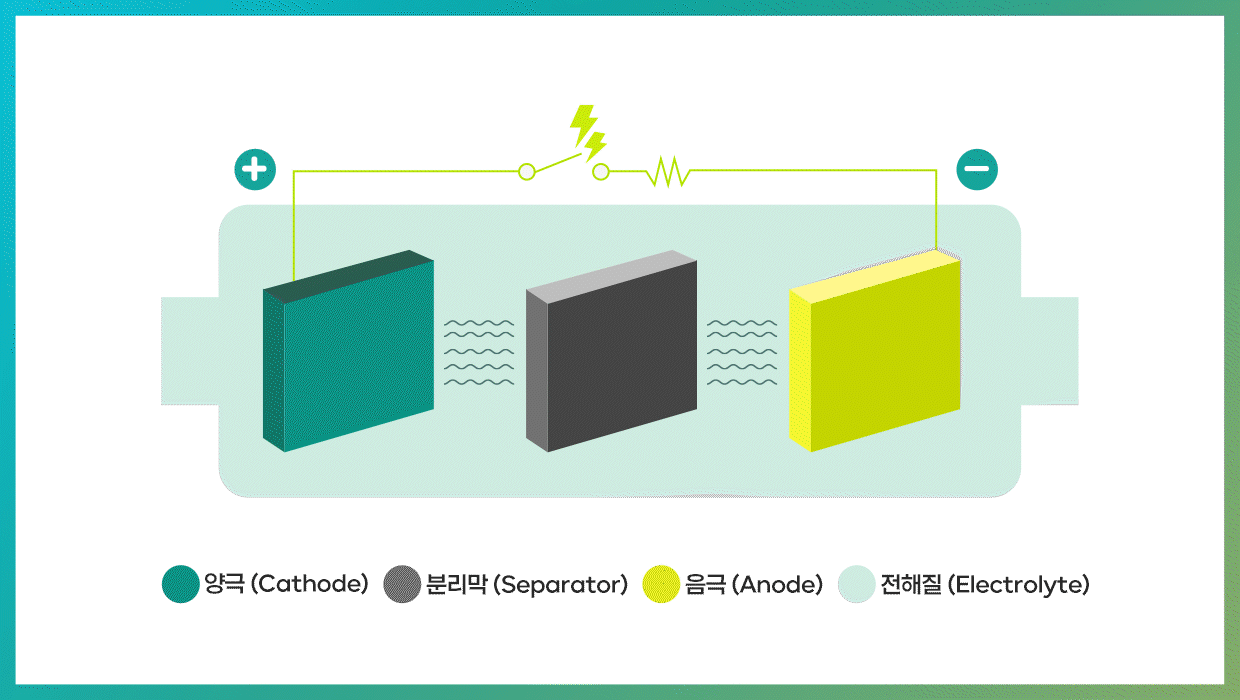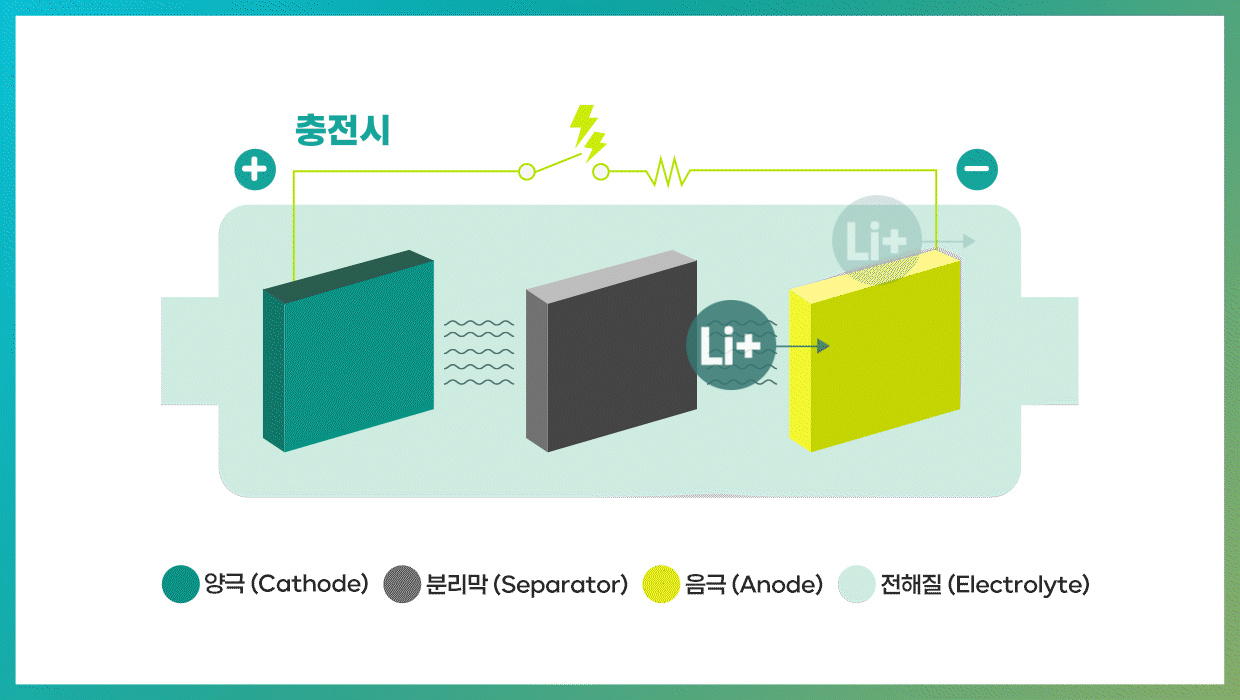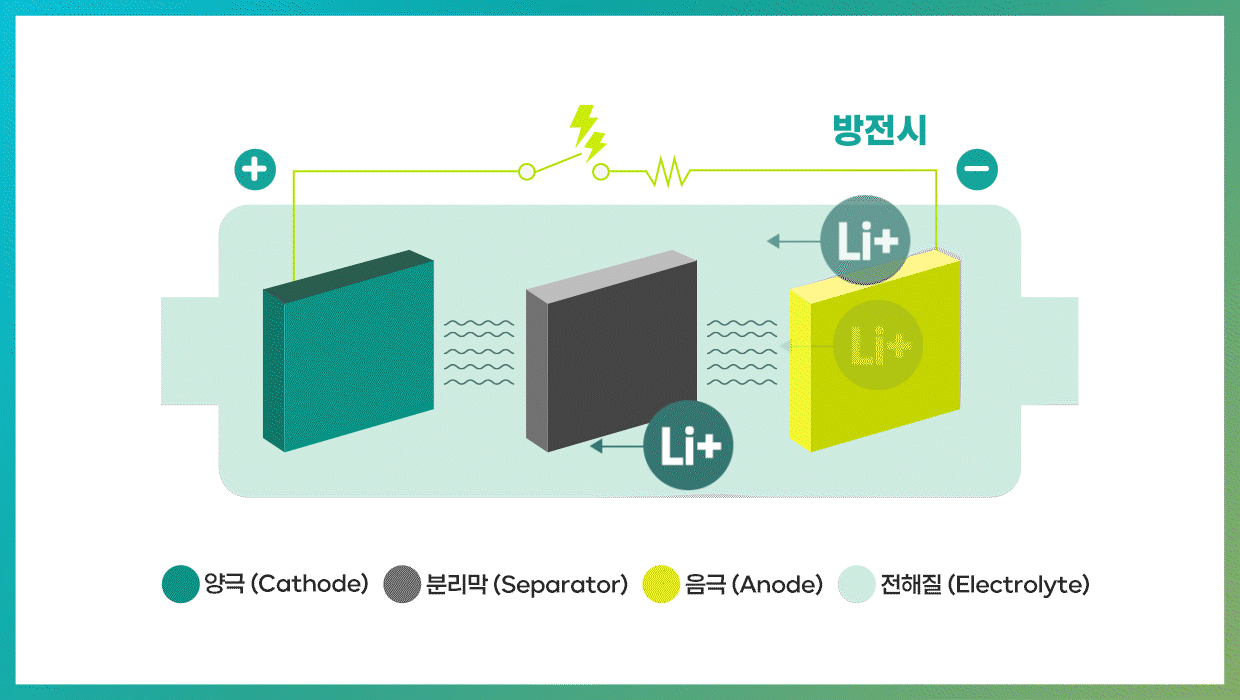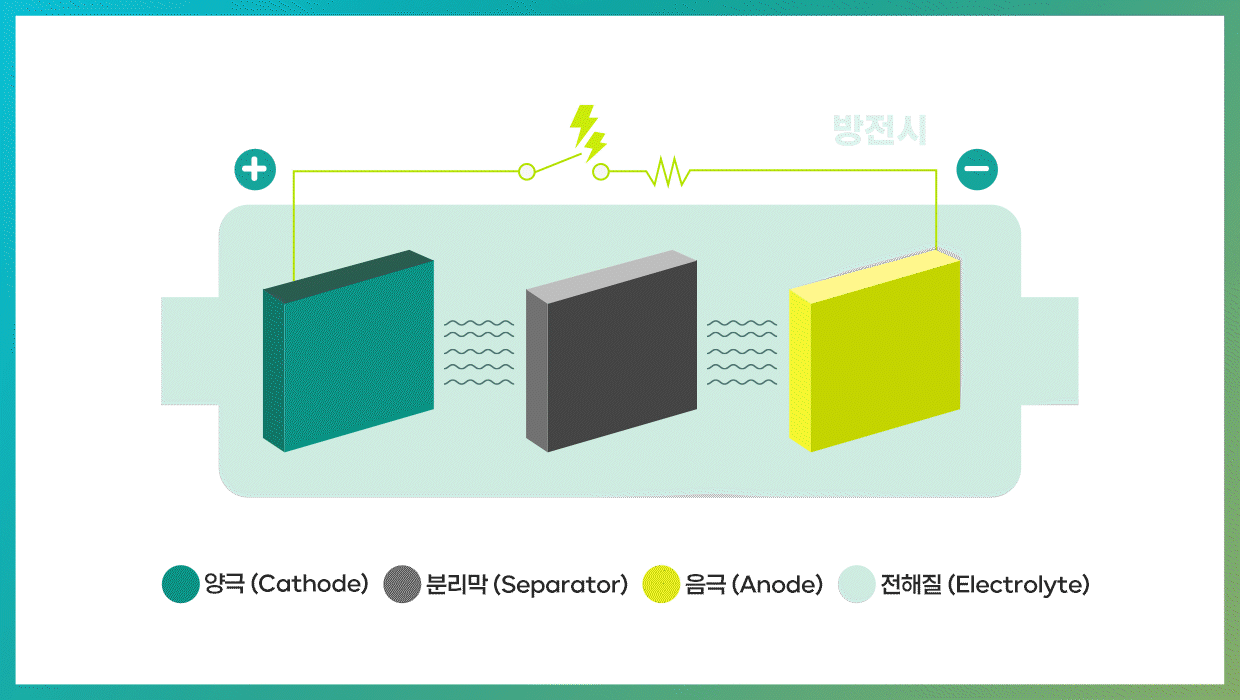
| 리튬이온 배터리의 용량과 출력을 좌우하는 양극
양극(Cathode)은 리튬이온 배터리에서 필수적인 ‘리튬’이 들어가는 공간으로, 충전 시 리튬이온이 전자를 잃어 산화되는 전극이다. 반면에 방전 시에는 리튬이온이 전자를 얻어 환원되는 전극이기도 하다. 양극(+)은 집전체*인 알루미늄 포일과 양극재(양극활물질), 도전재**와 바인더로 구성된다. 그중 양극활물질은 리튬을 비롯해 니켈(Ni, Nickel), 코발트(Co, Cobalt), 망간(Mn, Manganese), 철(Fe, Iron), 알루미늄(Al, Aluminum) 등 다양한 금속 원소로 구성되며, 이들의 조합에 따라 배터리의 용량과 출력이 결정된다.
(*) 집전체: 배터리 내부에 있는 약 10μm(마이크로미터) 두께의 막으로, 전기 저항이 낮으며 배터리의 충∙방전 중에 활물질로 전류를 전달하거나 활물질에서 전류를 전달하도록 구성된 요소
(**) 도전재: 양극활물질과 음극활물질 사이에서 전자 이동을 촉진시키는 물질
또한, 앞서 언급한 활물질의 조합에 따라 배터리 종류는 다음과 같이 분류한다.
● LCO(리튬, 코발트산화물) 배터리
● LMO(리튬, 망간산화물) 배터리
● LFP(리튬, 철, 인산) 배터리
● NCM(니켈, 코발트, 망간) 배터리
● NCA(니켈, 코발트, 알루미늄) 배터리
● LTO(리튬, 티탄산화물) 배터리
| 리튬이온 배터리의 수명과 충전속도를 결정하는 음극
음극(Anode)은 충전 시 리튬이온이 전자를 얻어 환원되는 전극이자, 방전 시 리튬이온이 전자를 잃어 산화되는 전극이다. 양극과는 반대되는 현상이 일어난다고 보면 쉽다. 음극은 집전체인 구리 포일과 음극재(음극활물질), 도전재와 바인더로 구성된다.
이 중 음극재는 배터리의 수명 및 충전속도에 중요한 역할을 한다. 음극재가 저장 가능한 리튬이온의 양이 더 많아질수록 배터리 수명은 증가하고, 리튬이온을 보다 잘 얻을수록 충전시간이 감소한다. 음극재의 성능에 따라 배터리의 성능이 변한다고 해도 과언이 아니다.

음극재 속 활물질, 즉 ‘음극활물질’의 소재로는 현재 가격과 안정성 측면에서 우수한 ‘흑연’이 가장 보편적으로 쓰인다. 음극재에 활용되는 흑연은 크게 천연흑연과 인조흑연으로 나뉜다. 천연흑연은 자연에서 확보할 수 있어 생산비용이 저렴하고 상대적으로 용량도 큰 편이다. 하지만 리튬이온 배터리 충전 시 리튬이온이 양극재에서 음극재로 이동하면서 이온이 흑연층 사이에 머물게 돼 흑연의 부피가 팽창한다. 이는 배터리 구조 변화를 일으키며, 이 같은 단점을 개선하기 위해 개발된 것이 인조흑연이다. 인조흑연의 경우 천연흑연에 비해 충전속도와 출력이 우수하지만, 인공적으로 제조해야 하므로 생산비용이 높고 용량은 다소 낮은 편이다.
최근에는 실리콘이 차세대 음극재 소재로 부상했다. 실리콘 음극재는 흑연계 음극재보다 에너지 밀도가 약 10배 높아 배터리 용량 증대가 가능한 것은 물론, 충전속도도 단축할 수 있기 때문이다. 흑연을 구성하는 탄소는 원자 6개에 리튬이온 1개를 저장할 수 있지만, 실리콘은 리튬이온과 결합해 원자 5개로 총 22개의 리튬이온을 저장할 수 있다. 따라서 실리콘 비율이 높아질수록 배터리 용량과 충전속도가 향상되기에 실리콘 음극재가 주목받는 것이다.
| 리튬이온 배터리의 성능과 안전성을 책임지는 분리막
분리막(Separator)은 양극과 음극 사이에 위치한 얇은 필름으로, 전기절연 특성을 지닌 미세다공성(Microporous) 막이다. 이는 충∙방전 시 배터리의 내부 단락을 방지하고, 전자가 잘못된 방향으로 이동하지 않도록 한 쪽 전극에서 다른 쪽 전극으로 이온만 통과시키는 역할을 한다. 분리막은 크게 안정성 및 성능에 중요한 역할을 하는 ‘베이스 필름’과 분리막의 열 안정성을 좌우하는 ‘코팅층’으로 구성된다.
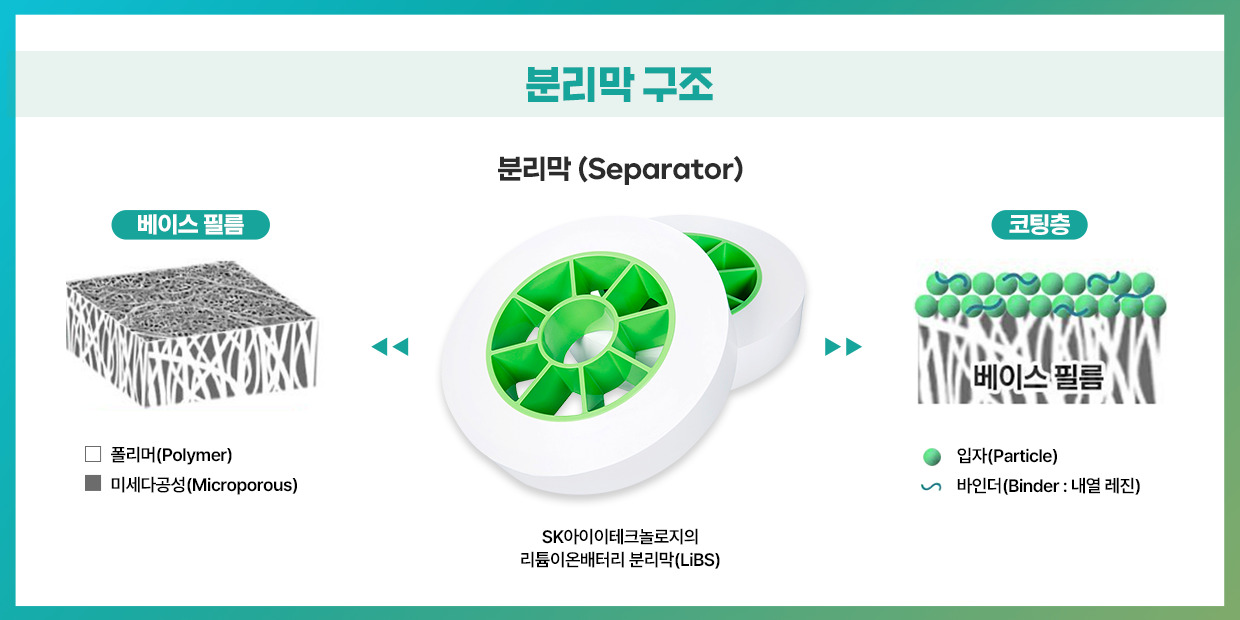
분리막은 베이스 필름 제조 공정에 따라 습식 분리막과 건식 분리막으로 분류한다. 습식 분리막은 열유도 상분리법***을 이용해 PE(Polyethylene, 폴리에틸렌)와 PP(Polypropylene, 폴리프로필렌)에 오일을 섞고, 고온∙고압에서 반죽한 후 식히며 오일 성분을 분리한다. 이후 이 오일 성분을 제거해 기공을 형성한다. 습식 분리막은 높은 에너지 밀도, 고용량 및 고출력, 얇은 두께의 분리막을 제조할 수 있다는 점, 그리고 기공의 크기와 분포가 균일한 분리막을 만들 수 있다는 장점이 있지만 생산비용이 높다는 단점을 가진다.
(***) 열유도 상분리법(thermally induced phase separation, TIPS) : 고온에서 용해되는 용매를 사용해 고온에서 제조하는 방법. 온도차에 의해 분리막이 제조되고 용매의 종류에 따라 기공의 크기가 결정됨
건식 분리막은 PE와 PP 소재를 고온∙고압에서 반죽 후 식혀 결정을 만드는데, 이를 기계로 잡아당겨 기공을 만드는 비교적 간단한 공정을 거친다. 우수한 전도성, 고온 및 산화에 대한 저항력이 뛰어나지만 기공 크기가 불균형하고 안정성이 낮다는 단점이 있다.
| 배터리 내 이온의 이동수단, 전해질
전해질(Electrolyte)은 리튬이온 배터리 내 양극과 음극 사이를 채우고 리튬이온 이동의 매개체 역할을 하는 물질이다. 배터리 충·방전 시 리튬이온이 전해질을 타고 양극과 음극을 오간다고 생각하면 된다. 전해질은 이온을 빠르고 안전하게 이동시키는 것이 주목적이므로, 화학∙전기적 안정성이 뛰어나야 하며, 다양한 온도 범위에서 작동하기 위해 어는점이 낮고 발화점이 높아야 한다. 더불어 전해질 내 이온의 이동속도를 의미하는 ‘이온전도도’도 높아야 한다. 리튬이온 이동속도가 빠를수록 배터리 출력이 커지고 고속으로 충전되기 때문이다.
전해질은 크게 액체 전해질(Liquid electrolyte)과 고체 전해질(Solid electrolyte)로 나뉜다. 그중 리튬이온 배터리에 사용하는 액체 전해질은 리튬이온의 이동통로인 리튬염(Lithium Salts), 리튬염을 용해시키는 액체인 유기용매(Organic Solvent), 전해질의 특성을 결정하는 첨가제(Additives)로 구성된다.
차세대 배터리로 주목받는 ‘전고체 배터리’는 액체 전해질 대신 고체 전해질을 사용한다. 이로 인해 양극과 음극의 접촉을 차단하는 분리막이 필요 없고, 리튬이온 배터리로 대표되는 기존 2차전지보다 안전성 및 에너지 밀도가 높아 ‘꿈의 배터리’라고도 불린다. 전고체 배터리에 사용되는 고체 전해질은 소재에 따라 황화물계, 산화물계, 폴리머계 등으로 나뉜다.

지금까지 2차전지를 구성하는 4대 핵심 요소인 양극, 음극, 분리막, 전해질에 대해 살펴봤다. 배터리의 용량과 출력을 좌우하는 양극, 배터리의 수명과 충전속도를 결정하는 음극, 성능과 안전성을 책임지는 분리막, 이온 이동의 매개체인 전해질까지! 이 네 가지가 각자의 역할을 다할 때 비로소 안정성과 성능이 우수한 배터리가 탄생할 수 있다.
| ‘전지적 배터리 시점’으로 바라본 SK이노베이션 계열
한편, SK이노베이션의 배터리 사업 자회사인 SK온은 NCM 배터리 분야에서 높은 기술력을 자랑한다. NCM622(니켈 60%, 코발트 20%, 망간 20%로 배합), NCM811(각각 80%, 10%, 10%)을 비롯해 중대형 리튬이온 배터리 최고사양인 NCM9+(각각 90%, 5%, 5%) 등 하이 니켈(High-nickel) 배터리를 세계 최초로 개발하며 시장을 선도 중이다. 나아가 현재 고분자-산화물 복합계 및 황화물계 등 두 종류의 전고체 배터리를 개발하고 있다. 각각 2025년, 2026년 파일럿(Pilot) 시제품을 생산하고 2028년, 2029년에는 상용화 시제품을 생산한다는 목표다. SK온의 대전 배터리연구원에 건설 중인 황화물계 차세대 배터리 파일럿 플랜트(Pilot plant)는 2025년 하반기 완공 예정이다.
SK이노베이션의 소재 사업 자회사 SK아이이테크놀로지 또한 독보적인 기술력으로 글로벌 습식 분리막 시장을 선도한다. SK아이이테크놀로지가 세계최초로 개발한 ‘축차연신’ 기술은 분리막을 균일한 품질로 종·횡방향으로 늘려, 원하는 물성과 두께의 분리막을 만드는 게 가능하다. 또한 세라믹코팅분리막(Ceramic Coated Separator, CCS) 기술을 통해 분리막의 내구성을 크게 높인다. CCS 기술은 미세한 세라믹층을 분리막 위에 도포하는 기술이다. 대용량 배터리에서 뿜어져 나오는 열에도 분리막이 변형되거나 수축되는 현상을 최대한 방지해 화재 위험을 낮춘다.
2차전지는 노트북, 스마트폰 등 다양한 휴대용 기기의 에너지원으로, 우리가 일상생활을 누리기 위한 필수적인 존재로 자리 잡은 지 오래다. 그러나 2차전지의 활용 분야는 여기서 그치지 않고 다양한 산업 분야로 확장되며 새로운 미래를 열어가고 있다. 이어지는 ‘전지적 배터리 시점’ 다음 편에서 더욱 자세히 살펴보도록 하자!